Πρώτη συνεδρίαση της Ομάδας Δράσης Ευρωβουλευτών για τη ρυθμιστική πορεία των ψυχεδελικών
Τη Δευτέρα 6 Νοεμβρίου πραγματοποιήθηκε στο Ευρωπαϊκό Κοινοβούλιο στις Βρυξέλλες η εναρκτήρια συνεδρίαση της Ομάδας Δράσης του Ευρωπαϊκού Κοινοβουλίου για την Ιατρική Χρήση των Ψυχεδελικών.
Η συνάντηση συνδιοργανώθηκε από την PAREA και την PsychedelicsEUROPE, οι οποίες προσκάλεσαν παρουσιάσεις από ερευνητές και βιομηχανία μέχρι ασθενείς και υποστηρικτές της πολιτικής.
Η ομάδα δράσης των ευρωβουλευτών, που συγκροτήθηκε τον Μάιο, επιδιώκει να προωθήσει την κλινική χρήση των ψυχεδελικών στην ΕΕ. Αυτή η πρώτη συνάντηση, με θέμα «Καινοτομώντας την ψυχική υγεία στη φαρμακευτική νομοθεσία της ΕΕ: Ρυθμιστικά μονοπάτια για ψυχεδελικές θεραπείες», αποσκοπούσε στη διερεύνηση του τρόπου με τον οποίο μια αναθεωρημένη δέσμη φαρμακευτικών μέτρων της ΕΕ θα μπορούσε να υποστηρίξει αυτόν τον τομέα.
Φαρμακευτική Νομοθεσία της ΕΕ
Η αναθεωρημένη φαρμακευτική δέσμη μέτρων της ΕΕ αποσκοπεί -μεταξύ άλλων- στην εξισορρόπηση της ανάγκης για ισότιμη και αποτελεσματική πρόσβαση σε ασφαλή και αποτελεσματικά φάρμακα με την ανάγκη παροχής κινήτρων για την ανάπτυξη και την κυκλοφορία καινοτόμων φαρμάκων στην Ευρώπη. Πρόκειται για τη σημαντικότερη αναθεώρηση της φαρμακευτικής νομοθεσίας της ΕΕ εδώ και δύο δεκαετίες.
Μέχρι στιγμής, οι προτεινόμενες αναθεωρήσεις έχουν συμπεριλάβει αλλαγές στο καθεστώς κανονιστικής αποκλειστικότητας. Επί του παρόντος, τα νέα φάρμακα λαμβάνουν 8 χρόνια προστασίας δεδομένων, ακολουθούμενα από 2 χρόνια προστασίας της αγοράς, παρέχοντας ουσιαστικά ένα μονοπώλιο 10 ετών που εμποδίζει την είσοδο γενόσημων. Οι χορηγοί μπορούν επίσης να κερδίσουν ένα επιπλέον έτος σε περίπτωση που επιτύχουν έγκριση για τουλάχιστον μία επιπλέον ένδειξη εντός 8 ετών από την έγκριση, εάν το προϊόν αποδεικνύει σημαντικό κλινικό όφελος έναντι των υφιστάμενων θεραπειών.
Μια πρώιμη πρόταση για την αναθεωρημένη φαρμακευτική στρατηγική φαίνεται ότι θα μειώσει την τυπική περίοδο προστασίας δεδομένων σε 6 έτη, με πλήρη 10ετή αποκλειστικότητα που θα είναι εφικτή μόνο όταν πληρούνται ορισμένα κριτήρια. Η περίοδος αποκλειστικότητας της αγοράς των 2 ετών παραμένει. Η παράταση της περιόδου προστασίας δεδομένων θα μπορούσε να επιτευχθεί με τους ακόλουθους τρόπους:
- Χορηγείται επιπλέον 2 έτη προστασίας δεδομένων όταν ένα νέο προϊόν κυκλοφορεί σε όλα τα κράτη μέλη της ΕΕ εντός 2 ετών από την έγκριση (αυτό επεκτείνεται σε 3 έτη για ορισμένες οντότητες, συμπεριλαμβανομένων των ΜΜΕ και των μη κερδοσκοπικών οργανισμών).
- 6 μήνες μπορούν να προστεθούν εάν το προϊόν αντιμετωπίζει μια ανεκπλήρωτη ιατρική ανάγκη: μια απειλητική για τη ζωή ή σοβαρά εξουθενωτική ασθένεια με ανεπαρκείς υπάρχουσες εναλλακτικές λύσεις.
- Η προθεσμία των 6 μηνών μπορεί επίσης να παραταθεί όταν το φάρμακο περιέχει νέα δραστική ουσία και όταν οι κλινικές δοκιμές χρησιμοποίησαν ένα τεκμηριωμένο συγκριτικό μέσο.
- Ένα επιπλέον έτος μπορεί να χορηγηθεί εάν επιτευχθεί άδεια κυκλοφορίας για μια πρόσθετη ένδειξη για μια πάθηση όπου υπάρχει σημαντικό κλινικό όφελος έναντι των υφιστάμενων θεραπειών.
Εκτός από αυτές τις αλλαγές στις περιόδους αποκλειστικότητας, η αναθεωρημένη δέσμη μέτρων ενδέχεται να οδηγήσει σε σημαντικές αλλαγές στη σύνθεση του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ), σε μια προσπάθεια να γίνει πιο αποτελεσματικός (που θα μπορούσε, για παράδειγμα, να επιταχύνει τα χρονοδιαγράμματα αναθεώρησης) και να εμβαθύνει το πρόγραμμα επιστημονικών συμβουλών του, για παράδειγμα.
Θα μπορούσαν επίσης να εισαχθούν ρυθμιστικά sandboxes, τα οποία θα επέτρεπαν στον ΕΜΑ να εξετάσει ευρύτερες πηγές δεδομένων, όπως δεδομένα από τον πραγματικό κόσμο και στοιχεία για τη χρήση υφιστάμενων φαρμάκων εκτός επισήμανσης.
Η περίοδος αναθεώρησης της εκτεταμένης φαρμακευτικής δέσμης προσφέρει ένα σημαντικό άνοιγμα για την ψυχεδελική έρευνα και την ανάπτυξη φαρμάκων, σύμφωνα με τους συμμετέχοντες στην εκδήλωση της Ομάδας Δράσης του Ευρωπαϊκού Κοινοβουλίου. Όσον αφορά τα χρονοδιαγράμματα, θα μπορούσε να είναι μια χρονοβόρα διαδικασία, χωρίς καθορισμένο χρονοδιάγραμμα για την έγκρισή της. Πολλοί αναμένουν ότι η διαδικασία θα επεκταθεί μέχρι το 2026 και πέραν αυτού.
Παρακάτω παραθέτουμε σημειώσεις για τη συνάντηση. Μπορείτε να παρακολουθήσετε μια ηχογράφηση των διαφανειών στον σύνδεσμο στο YouTube:
Ο Josh Hardman ξεκίνησε τη συζήτησή του με μια επισκόπηση των βασικών εξελίξεων στη σύνδεση της εξέλιξης των ψυχεδελικών ναρκωτικών και της πολιτικής/ρυθμιστικών θεμάτων. Υπογράμμισε ότι, ενώ οι ΗΠΑ έχουν χορηγήσει αρκετούς χαρακτηρισμούς πρωτοποριακής θεραπείας και το Ηνωμένο Βασίλειο έχει εκδώσει διαβατήρια καινοτομίας, κανένας υποψήφιος για την ανάπτυξη ψυχεδελικών φαρμάκων δεν έχει ακόμη λάβει τον χαρακτηρισμό "φάρμακα προτεραιότητας" στο πλαίσιο του συστήματος PRIME του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA).
Επεσήμανε την αξιοσημείωτη απουσία ψυχιατρικών φαρμάκων που έχουν επιτύχει έγκριση μέσω του PRIME, με μόλις δύο υποψήφια φάρμακα να έχουν εξεταστεί και τα οποία τελικά διακόπηκαν από τους χορηγούς τους. Αυτό έρχεται σε πλήρη αντίθεση με τον τομέα της ογκολογίας, στον οποίο 34 υποψήφιοι έχουν επιτύχει το καθεστώς PRIME.
Παρά την έλλειψη αυτή στην ταχεία έγκριση των ψυχεδελικών ουσιών, ο Hardman παρατήρησε ότι ο EMA έχει δείξει ανοιχτή υποστήριξη στην έρευνα στον τομέα αυτό. Αυτό αποδεικνύεται από ενέργειες όπως η συμμετοχή του Chief Medical Officer του EMA Steffen Thirstrup στη συνάντηση New Frontiers του ECNP για τα ψυχεδελικά, η υποστήριξη του τομέα στη σελίδα του EMA στο LinkedIn και η συμβολή του σε άρθρο του Lancet που συζητά το θέμα.
Στη συνέχεια, μετατόπισε το επίκεντρο στη στάση του κοινού και των επαγγελματιών απέναντι στις ψυχεδελικές θεραπείες. Σημείωσε ότι μια στενή πλειοψηφία του κοινού φάνηκε ανοιχτή στην ιδέα της χρήσης ψυχεδελικών θεραπειών για θέματα ψυχικής υγείας. Αναφέρθηκε στις δύο έρευνες των Barnett et al. οι οποίες έδειξαν σημαντική αύξηση του αριθμού των ψυχιάτρων που πιστεύουν ότι τα ψυχεδελικά έχουν δυνατότητες στη θεραπεία ψυχιατρικών διαταραχών.
Αφού ανέλυσε τις εξελισσόμενες παγκόσμιες πολιτικές και προοπτικές για τα ψυχεδελικά, αναφέρθηκε στο κύριο σημείο της παρουσίασής του: τη γεωγραφική κατανομή της ανάπτυξης ψυχεδελικών φαρμάκων και τη δυνατότητα έγκρισής τους.
Όσον αφορά το φάσμα της κλινικής ανάπτυξης, η θεραπεία με MDMA βρίσκεται στα πρόθυρα της έγκρισης στις ΗΠΑ, ενδεχομένως εντός του επόμενου έτους. Η ψιλοκυβίνη βρίσκεται επίσης στο δρόμο προς την έγκριση από τον FDA, ενδεχομένως εντός της επόμενης πενταετίας. Ανέφερε ότι η COMPASS Pathways έλαβε πρόσφατα την άδεια να ξεκινήσει την πρόσληψη σε διάφορες ευρωπαϊκές τοποθεσίες για μία από τις δοκιμές Φάσης 3, η οποία πραγματοποιήθηκε την επομένη της προετοιμασίας της παρουσίασής του.
Εξέφρασε την ανησυχία του για την αισθητή απουσία προγραμμάτων στην Ευρώπη που θα μπορούσαν να επιταχύνουν την έγκριση των ψυχεδελικών θεραπειών. Παρά τον σημαντικό αριθμό δοκιμών αρχικού έως μεσαίου σταδίου που λαμβάνουν χώρα στην Ευρώπη, με πολλές καίριες γνώσεις να προέρχονται από Ευρωπαίους ερευνητές, σημείωσε ότι το χρονοδιάγραμμα για την πρόσβαση των Ευρωπαίων σε εγκεκριμένες θεραπείες μπορεί να είναι σημαντικά μεγαλύτερο από ό,τι για τους Αμερικανούς.
Κατά την άποψή του, αυτή η διαφορά θα μπορούσε να οδηγήσει κάποιον να υποστηρίξει ότι οι Ευρωπαίοι χρησιμεύουν ουσιαστικά ως πειραματόζωα στον τομέα των ψυχεδελικών, παρομοιάζοντάς τους με πειραματόζωα ή πειραματόζωα σε πειραματικές μελέτες.
Τόνισε την πρώτη παγκοσμίως κλινική δοκιμή ψυχοθεραπείας με MDMA, η οποία ξεκίνησε στην Ισπανία το 2000, για να διακοπεί πρόωρα από τις τοπικές αρχές αφού θεραπεύτηκαν μόλις έξι από τους είκοσι εννέα συμμετέχοντες. Με την προοπτική της υποστηριζόμενης από MDMA θεραπείας για τη μετατραυματική διαταραχή στο κατώφλι της έγκρισης στις ΗΠΑ 24 χρόνια αργότερα, αναλογίστηκε την έκταση της καθυστέρησης που μπορεί να αντιμετωπιστεί στην Ισπανία -και ενδεχομένως στην υπόλοιπη Ευρώπη- όπου οι αρχικές κλινικές δοκιμές πραγματοποιήθηκαν πριν από δύο δεκαετίες.

Συνεχίζοντας να συζητά πιθανές λύσεις, ο Hardman έστρεψε την προσοχή του στην αναθεώρηση της φαρμακευτικής νομοθεσίας της ΕΕ. Εντόπισε ότι η εξασφάλιση χρηματοδότησης για βασικές μελέτες στην Ευρώπη αποτελεί κρίσιμο ζήτημα για τους προγραμματιστές ψυχεδελικών φαρμάκων, ιδίως στην τρέχουσα οικονομική συγκυρία.
Πρότεινε ότι η ΕΕ θα μπορούσε να ενισχύσει αυτές τις προσπάθειες μέσω κινήτρων και επιχορηγήσεων, οι οποίες θα μπορούσαν να συνδεθούν στρατηγικά με τις προτεραιότητες της δημόσιας υγείας. Αυτό θα μπορούσε να περιλαμβάνει την απαίτηση οι δοκιμές να περιλαμβάνουν ένα συγκριτικό στοιχείο που ευθυγραμμίζεται με τους στόχους του EMA και των κρατών μελών για τον εντοπισμό των πιο αποδοτικών από άποψη κόστους θεραπειών.
Ο Hardman είδε επίσης την αξία της βαθύτερης και νωρίτερης υποστήριξης από τον EMA, η οποία θα μπορούσε να εμπνεύσει μεγαλύτερη εμπιστοσύνη στους χρηματοδότες για την υποστήριξη ψυχεδελικών προγραμμάτων μεγάλης κλίμακας και προχωρημένου σταδίου.
Επεσήμανε την ελλιπή αξιοποίηση της υπηρεσίας επιστημονικών συμβουλών του EMA από τους προγραμματιστές ψυχιατρικών φαρμάκων, κάτι που η αναθεωρημένη στρατηγική στοχεύει να αντιμετωπίσει προσφέροντας προληπτικές συμβουλές.
Πέρα από τις επιστημονικές συμβουλές, ο Hardman πίστευε ότι η έγκαιρη εμπλοκή σε θέματα όπως η αξιολόγηση της τεχνολογίας υγείας και οι λογιστικές εκτιμήσεις θα μπορούσαν να παράσχουν στους προγραμματιστές ψυχεδελικών φαρμάκων μια σαφέστερη εικόνα του ρυθμιστικού τοπίου της ΕΕ. Ιδανικά, ο EMA θα αναγνώριζε τα δεδομένα που παράγονται εκτός Ευρώπης, μειώνοντας το βάρος της διεξαγωγής εκτεταμένων ευρωπαϊκών δοκιμών για την έγκριση του EMA.
Αντιμετωπίζοντας τον απαιτητικό σε πόρους χαρακτήρα των ψυχεδελικών θεραπειών και την πιθανότητα αποζημίωσής τους στην ΕΕ, ο Hardman πρότεινε ότι μια αξιολόγηση τεχνολογίας υγείας σε επίπεδο ΕΕ θα μπορούσε να υιοθετήσει μια κοινωνική προοπτική στις αναλύσεις κόστους-οφέλους, ώστε να αντιπροσωπεύει πλήρως το κόστος των διαταραχών της ψυχικής υγείας και τα ολοκληρωμένα οφέλη των παρεμβάσεων όπως οι ψυχεδελικές θεραπείες.
Συνέστησε επίσης να πρωτοστατήσει η ΕΕ στην υποστήριξη μελετών που διερευνούν πιο οικονομικά αποδοτικά μοντέλα ψυχεδελικών θεραπειών, όπως η ομαδική θεραπεία ή οι συγκριτικές δοκιμές.
Ο Hardman σχολίασε την προτεινόμενη αναθεώρηση της φαρμακευτικής δέσμης, η οποία θα μπορούσε να προσφέρει αποκλειστικότητα στην αγορά για τους χορηγούς που θα κυκλοφορήσουν και στα 27 κράτη μέλη εντός λίγων ετών από την έγκριση. Αναγνώρισε τις υλικοτεχνικές απαιτήσεις και τις απαιτήσεις υποδομής των ψυχεδελικών θεραπειών, προτείνοντας την ανάπτυξη προσαρμόσιμων μοντέλων για τα κράτη μέλη σε επίπεδο ΕΕ για τη διευκόλυνση αποτελεσματικότερων λανσαρισμάτων.
Στις καταληκτικές παρατηρήσεις του, ο Hardman τόνισε ότι:
- Οι Ευρωπαίοι αναγνωρίζουν τις δυνατότητες των ψυχεδελικών θεραπειών.
- Πολλοί κορυφαίοι ερευνητές και προγραμματιστές ψυχεδελικών θεραπειών κατοικούν στην Ευρώπη.
- Η πλειονότητα της ρυθμιστικής ευελιξίας και της υποστήριξης για την προηγμένη ανάπτυξη ψυχεδελικών φαρμάκων συμβαίνει εκτός Ευρώπης.
- Οι Ευρωπαίοι μπορεί να γίνουν απλά πειραματόζωα για καινοτομίες που αργότερα θα αναπτυχθούν πλήρως στη Βόρεια Αμερική.
- Η ΕΕ και οι οργανισμοί της έχουν την ευκαιρία να στηρίξουν ενεργά τον τομέα των ψυχεδελικών φαρμάκων, καλύπτοντας ουσιαστικές ανεκπλήρωτες ανάγκες στην Ευρώπη.

Ακολούθησε ο Tadeusz Hawrot, ιδρυτής και εκτελεστικός διευθυντής της PAREA, ο οποίος ανέπτυξε την κλίμακα των ανεκπλήρωτων αναγκών στις οποίες οι ψυχεδελικές θεραπείες μπορούν να συμβάλουν.
Σύμφωνα με το EU Health at a Glance 2018, 1 στους 6 ανθρώπους στην Ευρώπη αντιμετωπίζει κάποιο πρόβλημα ψυχικής υγείας, ενώ 1 στους 2 κατοίκους της ΕΕ αντιμετωπίζει ψυχική ασθένεια κάποια στιγμή στη διάρκεια της ζωής του. Ο οικονομικός και κοινωνικός αντίκτυπος αυτών των ασθενειών είναι τεράστιος. Σε τέτοιο βαθμό που η έκθεση Global Risks Report 2023 του Παγκόσμιου Οικονομικού Φόρουμ χαρακτηρίζει την επιδείνωση της ψυχικής υγείας ως βασικό κίνδυνο για τις οικονομίες και τις κοινωνίες.
Επιπλέον, θεραπεία είναι εντελώς ανεπαρκής: Ο ΠΟΥ στην Ευρώπη εκτιμά ότι τρία στα τέσσερα άτομα με μείζονα κατάθλιψη δεν λαμβάνουν επαρκή θεραπεία. Κάθε χρόνο μόνο στην Ευρώπη, 130.000 πεθαίνουν από αυτοκτονία: δηλαδή, από το 2016, ένα εκατομμύριο Ευρωπαίοι έχουν χάσει τη ζωή τους από αυτοκτονία. (Στην ενότητα "Ερωτήσεις και απαντήσεις", ο David Nutt υπέδειξε ότι τα ποσοστά αυτοκτονιών ήταν ένας βασικός λόγος για τον οποίο η TGA αποφάσισε να θεσπίσει νωρίτερα φέτος έναν περιορισμένο επαναπρογραμματισμό της ψιλοκυβίνης και του MDMA για την ανθεκτική στη θεραπεία κατάθλιψη και τη μετατραυματική διαταραχή του μετατραυματικού στρες, αντίστοιχα).
Οι μελλοντικές προβλέψεις δείχνουν ότι η κατάθλιψη θα γίνει η κύρια αιτία επιβάρυνσης από ασθένειες μέχρι το τέλος της δεκαετίας. Το κρίσιμο είναι ότι οι εκτιμήσεις σχετικά με τις δυνατότητες μείωσης της επιβάρυνσης των ασθενειών έως το 2040 είναι πολύ απαισιόδοξες όσον αφορά τις διαταραχές της ψυχικής υγείας. Μια εκτίμηση της McKinsey ανέφερε ότι μόλις το 14% της επιβάρυνσης αναμένεται να μπορεί να προληφθεί σε ένα σενάριο υγιούς ανάπτυξης.
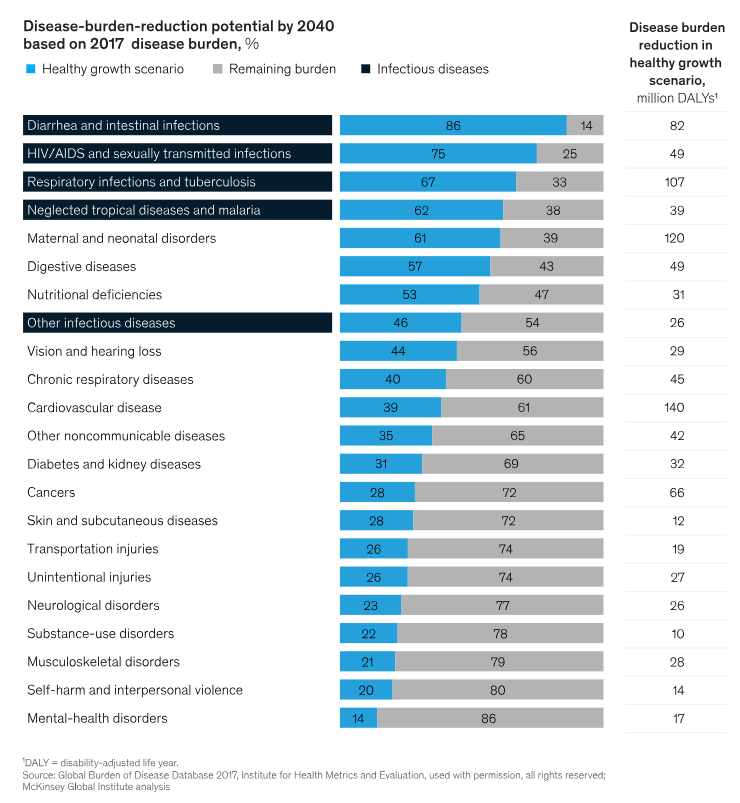
Η στασιμότητα στην ανάπτυξη νέων θεραπευτικών ουσιών για τις ψυχικές διαταραχές ενισχύει αυτές τις κάπως δυσοίωνες προοπτικές. Τονίζει όμως επίσης την ανάγκη υποστήριξης νέων υποσχόμενων θεραπειών, όπως οι ψυχεδελικά υποβοηθούμενες θεραπείες.
Καθορισμός των ανεκπλήρωτων ιατρικών αναγκών
Οι εισηγητές της συνάντησης μοιράστηκαν μια σειρά από δράσεις που θα μπορούσαν να αναλάβουν η ΕΕ, οι οργανισμοί της και τα κράτη μέλη για να προωθήσουν την ανάπτυξη και την εξάπλωση των ψυχεδελικών θεραπειών, όπως χρηματοδότηση και κίνητρα, καθώς και σχεδιασμός σε επίπεδο ΕΕ για την υλικοτεχνική υποδομή και την αποζημίωση, ώστε να προλάβουν τις προβλέψιμες δυσκολίες.
Μια ευθυγραμμισμένη προσέγγιση είναι να διευρύνουμε τα όρια όσον αφορά τον ορισμό των "ανεκπλήρωτων ιατρικών αναγκών". Η διασφάλιση ότι η τρομερή πραγματικότητα της ψυχικής υγείας θα καταγραφεί από έναν τέτοιο ορισμό θα μπορούσε να ωθήσει την ευρύτερη υποστήριξη για την έρευνα και την ανάπτυξη πιθανών καινοτομιών, μεταξύ των οποίων θα μπορούσαν να συγκαταλέγονται και οι ψυχεδελικές θεραπείες.
Για το σκοπό αυτό, η PAREA παρουσίασε ένα νέο έγγραφο πολιτικής, με τίτλο "Ανεκπλήρωτες ιατρικές ανάγκες": Ευθυγράμμιση της ιατρικής καινοτομίας με τις κοινωνικές ανάγκες υγείας. Το έγγραφο ζητά μια ευρύτερη αντίληψη των "ανεκπλήρωτων ιατρικών αναγκών", υποστηρίζοντας ότι η στενή εστίαση σε "απειλητικές για τη ζωή ή σοβαρά εξουθενωτικές καταστάσεις" παραμελεί το τεράστιο κοινωνικό κόστος και το κόστος υγειονομικής περίθαλψης των διαταραχών της ψυχικής υγείας και της χρήσης ουσιών.
Εάν οι παθήσεις αυτές ενταχθούν στην ομπρέλα των "ανεκπλήρωτων ιατρικών αναγκών" μέσω της τελειοποίησης των κριτηρίων αυτών, θα μπορούσαμε να τις δούμε να αποκτούν καταλληλότερη προτεραιότητα όσον αφορά τα κίνητρα Ε&Α.
Το έγγραφο θέσης ζητά τη δημιουργία ενός ευρωπαϊκού κόμβου για την Ε&Α στον τομέα της ψυχικής υγείας. Αυτός ο κόμβος θα φέρει σε επαφή μεταξύ τους τα θεσμικά όργανα της ΕΕ και των κρατών μελών, τους χρηματοδότες της υγειονομικής περίθαλψης και τους φιλάνθρωπους, δημιουργώντας μια κοινή ερευνητική υποδομή που θα συμπληρώνεται από καθοδήγηση και υποστήριξη.

Στη συνέχεια, η Maryam Jabir μοιράστηκε την εμπειρία της ως συμμετέχουσα σε μια μελέτη φάσης 2β της θεραπείας με ψιλοκυβίνη για την ανθεκτική στη θεραπεία κατάθλιψη.
Έχοντας παλέψει με την κατάθλιψη για πολλά χρόνια, η Maryam είπε ότι είχε δοκιμάσει επανειλημμένα ψυχοθεραπευτικά προγράμματα σε σημείο που είχε σχεδόν αρχίσει να παίζει τις συνεδρίες της: προσπαθούσε να κάνει τον θεραπευτή της να γελάσει, για παράδειγμα. Το μυαλό της ήταν "σαν γόρδιος δεσμός" σε αυτό το σημείο, είπε.
Δεν αποτελεί, λοιπόν, ίσως έκπληξη το γεγονός ότι η Maryam ενθουσιάστηκε όταν έπεσε πάνω σε ένα δημοσίευμα των μέσων ενημέρωσης που περιείχε μια φράση από έναν συμμετέχοντα σε κλινική δοκιμή ψιλοκυβίνης σχετικά με το πώς το φάρμακο μπορεί να "επαναφέρει" τον εγκέφαλο κάποιου. Έκανε αίτηση συμμετοχής στη δοκιμή.
Αν και λέει ότι δεν περίμενε μια ασημένια σφαίρα, ήλπιζε ότι θα μπορούσε να προσφέρει "μια σχεδία, ή ακόμα και κάποιο παρασυρόμενο ξύλο" από το οποίο θα μπορούσε να τραβήξει τον εαυτό της στην ακτή και να αρχίσει να καλυτερεύει.
(Σημείωση: θα πρέπει πραγματικά να ακούσετε την κατάθεση της Maryam με τα δικά της λόγια. Εδώ είναι ένας σύνδεσμος για την ηχογράφηση, ο οποίος θα σας μεταφέρει στο σχετικό τμήμα στο 33:18).
Προχωρώντας στη δοκιμή, η Maryam λέει ότι προσπάθησε σκόπιμα να υπο-εξετάσει την ψιλοκυβίνη για να αποφύγει την προετοιμασία του εαυτού της, και μόνο στη δεύτερη συνεδρία προετοιμασίας με τον θεραπευτή της μελέτης συνειδητοποίησε ότι μπορεί να έχει μια πλήρη ψυχεδελική εμπειρία. Ανησυχούσε επίσης ότι μπορεί να μην ήταν στο "ενεργό" σκέλος της δοκιμής, δηλαδή στην ομάδα των 25mg ψιλοκυβίνης (σε αντίθεση με τη δόση των 10mg ή του 1mg). Η Maryam πρότεινε ότι αυτή ήταν μία από τις πρωταρχικές ανησυχίες της... δεν είχε καν σκεφτεί ότι θα μπορούσε να "χειροτερέψει" μετά τη λήψη ψιλοκυβίνης.
Πράγματι, είχε "αυτό που κατ' ευφημισμόν ονομάζεται προκλητική εμπειρία", η οποία έμοιαζε με "τυφώνα". Μόλις βγήκε από την εμπειρία, η Maryam είπε ότι ένιωσε "σαν να είχα αποτύχει στην ομάδα, στο φάρμακο, στη μαμά μου". Ήταν μια πολύ δύσκολη στιγμή, είπε.
"Θέλω επίσης να είμαι πολύ σαφής", είπε η Maryam, ότι η δόση ψιλοκυβίνης "δεν έκανε τίποτα χειρότερο", αλλά την έκανε να αντιμετωπίσει πολλά δύσκολα πράγματα ταυτόχρονα. Διερωτήθηκε για το τι θεωρείται "ιδανική ανταπόκριση" στη θεραπεία με ψιλοκυβίνη: "Είναι ένα ταξίδι που προκαλεί ευεξία ή είναι πρόοδος; Είναι ευτυχία ή είναι θεραπεία;"
Αν είστε επιφυλακτικοί απέναντι στην ψυχεδελική θεραπεία ή αν το άκουσμα της ιστορίας μου σας απασχολεί αυτή τη στιγμή, θα σας καλούσα απλώς να επαναπροσδιορίσετε την έννοια του τι σημαίνει θεραπευτική. Για μένα, είναι όπως είπα στον θεραπευτή μου: Θέλω να αισθάνομαι καλύτερα. Το πρώτο πράγμα που είπα όταν με έβγαλαν από την εμπειρία ήταν: Δεν μπορώ να συνεχίσω έτσι μόνη μου, χρειάζομαι βοήθεια. Και για μένα, αυτό ήταν ένα τεράστιο πράγμα που αναγνώρισα".
Αν και η εμπειρία της ήταν σαφώς δύσκολη - "ένα από τα δυσκολότερα πράγματα που έχω περάσει ποτέ"- η Maryam δήλωσε ότι θα τα έκανε όλα ξανά, "ακριβώς όπως συνέβησαν". Τα οφέλη της εμπειρίας της "πήραν τη γραφική διαδρομή", είπε, προσθέτοντας ότι "είναι αναμφισβήτητο για μένα τι δύναμη θα μπορούσαν να έχουν αυτές οι θεραπείες στη φροντίδα της ψυχικής υγείας- μια δύναμη που έχει τη δυνατότητα να θεραπεύσει", σε αντίθεση με τον έλεγχο των ζημιών.
Η ίδια εκτίμησε πολύ την ομάδα της δίκης. "Είναι απογοητευτικό να γνωρίζω ότι δεν μπορώ να αναζητήσω ξανά θεραπεία" πρόσθεσε, υπονοώντας την έλλειψη επιλογών, προσθέτοντας ότι "δεν θα αισθανόμουν ποτέ αρκετά ασφαλής για να το κάνω χωρίς παρόμοια διαθέσιμη υποστήριξη".
Η Maryam δήλωσε ότι από την άριστη φροντίδα που είχε κατά τη διάρκεια της δοκιμής μετατράπηκε σε σχεδόν καθόλου. Οι ομάδες ένταξης στην κοινωνία που καθοδηγούνται από ομότιμους είναι τόσο σημαντικές, είπε. (Συμπτωματικά, λίγες ώρες πριν από την ομιλία της Maryam, δημοσιεύθηκε μια εργασία στο περιοδικό Neuroethics με τίτλο: When the Trial Ends: The Case for Post-Trial Provisions in Clinical Psychedelic Research.)

Στη συνέχεια, ο Tomáš Pálenícek εξέτασε την καθιερωμένη θεραπεία για την κατάθλιψη, πριν τη συγκρίνει με τα αναδυόμενα στοιχεία για τα ψυχεδελικά ως αντικαταθλιπτικά. Τα δεδομένα θα είναι γνωστά στους αναγνώστες, αλλά μερικές δοκιμές φάσης 2 στο Εθνικό Ινστιτούτο Ψυχικής Υγείας της Τσεχίας μπορεί να έχουν περάσει απαρατήρητες.
Και οι δύο δοκιμές επιδιώκουν να συγκρίνουν την ψιλοκυβίνη με την κεταμίνη, με μια ομάδα μιδαζολάμης ως ένα είδος ενεργού ελέγχου. Η πρώτη συγκρίνει τα δύο φάρμακα σε ανθεκτική στη θεραπεία κατάθλιψη, ενώ η δεύτερη εξετάζει την κατάθλιψη που συνυπάρχει με διάγνωση καρκίνου.
Ο Tomáš μοιράστηκε μερικές από τις προκλήσεις και το κόστος κατά τη διεξαγωγή κλινικών δοκιμών με ψυχεδελικά, όπως η απόκτηση φαρμακευτικού προϊόντος GMP, η εκπαίδευση θεραπευτών και γενικά η τήρηση των κριτηρίων έγκρισης κλινικών δοκιμών με πιο μετριοπαθείς προϋπολογισμούς σε σύγκριση με τους χορηγούς της βιομηχανίας.

Ο Viktor Chvátal, Γενικός Γραμματέας της PsychedelicsEUROPE, τόνισε τους βασικούς στόχους της οργάνωσής του: την εναρμόνιση των κανόνων για το "άνοιγμα της ενιαίας αγοράς της ΕΕ για την ιατρική χρήση των ψυχεδελικών", τη συμπερίληψη των ψυχεδελικών σε βασικές πρωτοβουλίες της ΕΕ, όπως η φαρμακευτική δέσμη και ο Ορίζοντας, καθώς και τη διάθεση κονδυλίων για την ψυχεδελική έρευνα τόσο από την ΕΕ όσο και από τα κράτη μέλη.
Ο Viktor προέτρεψε για μεγαλύτερη συμμετοχή του ιδιωτικού τομέα σε αυτές τις προσπάθειες και εξήγησε ότι η οργάνωσή του θα επιδιώξει να εμπλέξει τους πληρωτές στο θέμα της αποζημίωσης.

Τελευταίος ήταν ο Damian Kettlewell, Διευθύνων Σύμβουλος της Clairvoyant Therapeutics, εταιρείας ανάπτυξης φαρμάκων με ψιλοκυβίνη, η οποία συμμετέχει σε μια μελέτη φάσης 2β της θεραπείας με ψιλοκυβίνη για τη διαταραχή χρήσης αλκοόλ (AUD). Σημείωσε τα θετικά δεδομένα από τη μελέτη των Bogenschutz et al. (2022) για τη θεραπεία με ψιλοκυβίνη για την AUD, η οποία διαπίστωσε μείωση κατά 80% των ημερών βαριάς κατανάλωσης αλκοόλ μεταξύ των ατόμων που συμμετείχαν στην ομάδα της ψιλοκυβίνης, και δήλωσε ότι ο σχεδιασμός της δοκιμής της εταιρείας του είναι πολύ παρόμοιος. (Διαβάστε την ανάρτηση για τη μελέτη των Bogenschutz et al.).
Στόχος της εταιρείας είναι να είναι η "1η εταιρεία παγκοσμίως που θα ιατρικοποιήσει την ψιλοκυβίνη", με μια "στρατηγική ταχύτητας στην αγορά που έχει σχεδιαστεί για να επιτρέψει τη θεραπεία με ψιλοκυβίνη στην ΕΕ, το Ηνωμένο Βασίλειο και τον Καναδά" από το 2026. Με άλλα λόγια, η εταιρεία ελπίζει να προλάβει την COMPASS Pathways για την έγκριση στην αγορά ενός φαρμακευτικού προϊόντος που περιέχει ψιλοκυβίνη οπουδήποτε στον κόσμο, αλλά ο αναμφισβήτητα πιο ασφαλής στόχος της είναι να επιτύχει την έγκριση της θεραπείας με ψιλοκυβίνη για το AUD σε ορισμένες δικαιοδοσίες πρώην ΗΠΑ.
Ο Kettlewell μοιράστηκε ότι η εταιρεία έχει, από τις 3 Νοεμβρίου, τυχαιοποιήσει 63 συμμετέχοντες στη μελέτη Φάσης 2β που εξετάζει μια δόση 25 mg ψιλοκυβίνης έναντι εικονικού φαρμάκου σε δύο δοσολογικές συνεδρίες (με διαφορά 4 εβδομάδων), στην οποία αναμένεται να ολοκληρωθεί η εγγραφή -με στόχο 128 συνολικά συμμετέχοντες- έως τον Απρίλιο του 2024. Τα ενδιάμεσα αποτελέσματα που αντιπροσωπεύουν 64 συμμετέχοντες αναμένονται τον Φεβρουάριο του 2024. Η πλειονότητα των συμμετεχόντων προέρχεται από την ΕΕ, με τέσσερις ενεργές τοποθεσίες στη Φινλανδία.
Η εταιρεία είναι αρνητική ως προς την αυστηρότητα των πατεντών για την ψιλοκυβίνη, με τον Kettlewell να λέει ότι "δεν πιστεύουμε ότι οι πατέντες είναι ισχυροί ανασταλτικοί παράγοντες [...] όσον αφορά τα κλασικά φάρμακα όπως η ψιλοκυβίνη, το MDMA, το DMT και το LSD". Αντ' αυτού, ελπίζει να επωφεληθεί από την αποκλειστικότητα δεδομένων: σήμερα ορίζεται σε περίπου 10 χρόνια στην ΕΕ, αν και αυτό μπορεί να αλλάξει με τις προαναφερθείσες αναθεωρήσεις της φαρμακευτικής νομοθεσίας της ΕΕ.
Σκεπτόμενος την εμπειρία τους από την εργασία σε δοκιμές στην ΕΕ, ο Kettlewell δήλωσε ότι η πρόσληψη ασθενών ήταν πολύ ισχυρή στη Φινλανδία, με "πολύ μεγάλο ενδιαφέρον" και από τους θεραπευτές. Είπε επίσης ότι η Clairvoyant ελπίζει σε ευκαιρίες χρηματοδότησης Ε&Α, προσθέτοντας ότι αυτό αποτελεί κίνητρο για την εταιρεία να δημιουργήσει παρουσία στην Πορτογαλία.
Όσον αφορά τις προκλήσεις, ο Kettlewell δήλωσε ότι αντιλαμβάνεται κάποια "απροθυμία στην ψυχεδελική έρευνα" στην Ανατολική Ευρώπη. Πρόσθεσε ότι είναι πρόκληση για μια εταιρεία εκτός ΕΕ να έχει πρόσβαση σε επιλογές χρηματοδότησης από την ΕΕ. Τέλος, σημείωσε ότι οι προτεινόμενες αλλαγές στην αποκλειστικότητα των δεδομένων στην ΕΕ δημιουργούν αβεβαιότητα, γεγονός που δεν προκαλεί έκπληξη, καθώς η εμπορική στρατηγική της εταιρείας εξαρτάται σε μεγάλο βαθμό από την υπερμεγέθη περίοδο αποκλειστικότητας των δεδομένων που προσφέρει η ΕΕ σε σχέση, ας πούμε, με τις ΗΠΑ.

Κλείνοντας τη συνάντηση, η Deirdre Ryan, πρόεδρος της Pain Alliance Europe, σημείωσε ότι οι "ανεκπλήρωτες ανάγκες" σε αυτόν τον τομέα είναι συχνά "ζήτημα ζωής και θανάτου για τους ανθρώπους". "Χρειαζόμαστε πραγματικά πρωταθλητές σε εθνικό επίπεδο, τα κράτη μέλη, για να το υποστηρίξουν αυτό", πρόσθεσε, σημειώνοντας ότι "η ΕΕ θα μας λέει πάντα: πρέπει να προέρχεται από τα κράτη μέλη- και τα κράτη μέλη πάντα λένε "όχι, χρειαζόμαστε την ΕΕ να μας πει τι να κάνουμε".
Η ίδια ενθάρρυνε τη γεφύρωση του κενού, με τους ασθενείς, τις ρυθμιστικές αρχές, τους πληρωτές, τους ερευνητές και τη βιομηχανία να συναντηθούν με τρόπο που να περιλαμβάνει πολλά ενδιαφερόμενα μέρη για την περαιτέρω στήριξη αυτού του τομέα και άλλων θεραπειών ψυχικής υγείας.
Η Ράιαν υπενθύμισε επίσης ότι οι εκλογές πλησιάζουν σύντομα, αναφερόμενος στις κάλπες του Ιουνίου 2024.








