Όσα Έγιναν στην Ακρόαση της FDA για το MDMA και Τι Προβλέπεται: Μια σύντομη διερεύνηση
Γραφει η Ελεάνα Μπασκούτα
Το ταξίδι του MAPS/Lykos Therapeutics και οι προσπάθειες έγκρισης του FDA για το MDMA για το PTSD
Η Διεπιστημονική Ένωση Ψυχεδελικών Μελετών (MAPS), που τώρα λειτουργεί ως Lykos Therapeutics, έχει ξεκινήσει μια αδιάκοπη προσπάθεια να εξασφαλίσει την έγκριση του FDA για τη χρήση του MDMA στη θεραπεία της διαταραχής μετατραυματικού στρες (PTSD). Η MAPS, που ιδρύθηκε το 1986, υπερασπίζεται εδώ και καιρό τις δυνατότητες της θεραπείας με τη βοήθεια του MDMA να φέρει επανάσταση στη θεραπεία της ψυχικής υγείας. Το ταξίδι ήταν επίπονο, περιλαμβάνοντας εκτεταμένη έρευνα και κλινικές δοκιμές με στόχο την απόδειξη της αποτελεσματικότητας και της ασφάλειας του MDMA.
Τα τελευταία χρόνια, η θεραπεία με τη βοήθεια MDMA έχει δείξει πολλά υποσχόμενα αποτελέσματα. Δύο κλινικές δοκιμές Φάσης 3 που διεξήχθησαν από την MAPS κατέδειξαν σημαντικές βελτιώσεις στα συμπτώματα PTSD μεταξύ των συμμετεχόντων. Η πρώτη δοκιμή αποκάλυψε ότι το 67% των συμμετεχόντων δεν πληρούσε πλέον τα κριτήρια για PTSD μετά τη θεραπεία με MDMA, σε σύγκριση με το 32% στην ομάδα εικονικού φαρμάκου. Η δεύτερη δοκιμή ανέφερε παρόμοια αποτελέσματα, με το 71% της θεραπευτικής ομάδας να παρουσιάζει αξιοσημείωτες βελτιώσεις έναντι 48% στην ομάδα του εικονικού φαρμάκου. Παρά αυτά τα ενθαρρυντικά αποτελέσματα, ο δρόμος προς την έγκριση από τον FDA ήταν γεμάτος προκλήσεις. Η πιο πρόσφατη εξέλιξη σε αυτό το έπος σημειώθηκε στις 4 Ιουνίου 2024, όταν η Συμβουλευτική Επιτροπή Ψυχοφαρμακευτικών Φαρμάκων του FDA πραγματοποίησε δημόσια ακρόαση για να εξετάσει τα στοιχεία και να ψηφίσει σχετικά με την έγκριση του MDMA για τη θεραπεία της PTSD.
Η ακρόαση του FDA
Κατά τη διάρκεια της ακρόασης, η συμβουλευτική επιτροπή έριξε μια κριτική ματιά στα δεδομένα που παρουσίασε η Lykos Therapeutics. Η ψήφος ήταν συντριπτικά κατά της έγκρισης, με πλειοψηφία 9-2 που δήλωσε ότι τα διαθέσιμα δεδομένα δεν αποδεικνύουν πειστικά την αποτελεσματικότητα του MDMA για τη θεραπεία της PTSD. Επιπλέον, η ψήφος 10-1 έδειξε ότι τα οφέλη δεν υπερτερούν των κινδύνων, ακόμη και με την προτεινόμενη από τον FDA στρατηγική αξιολόγησης και μετριασμού των κινδύνων (REMS).
Οι κύριες ανησυχίες της επιτροπής περιλάμβαναν ζητήματα τυφλότητας στις δοκιμές (blinding protocol), πιθανή κατάχρηση του MDMA, μη αναφερόμενα ανεπιθύμητα συμβάντα και έλλειψη ποικιλομορφίας μεταξύ των συμμετεχόντων στις δοκιμές. Το ζήτημα της τύφλωσης ήταν ιδιαίτερα αμφιλεγόμενο, καθώς είναι δύσκολο να αποτραπεί στους συμμετέχοντες και τους ερευνητές να αναγνωρίσουν ποιος έλαβε MDMA λόγω των έντονων ψυχοδραστικών επιδράσεων του. Αυτή η λειτουργική απεμπλοκή θα μπορούσε να μεροληπτήσει τα αποτελέσματα, εγείροντας ερωτήματα σχετικά με την εγκυρότητα των ευρημάτων. Επιπλέον, η επιτροπή επισήμανε ανησυχίες για την ασφάλεια, όπως οι καρδιαγγειακοί κίνδυνοι που σχετίζονται με τους αυξημένους καρδιακούς παλμούς και την αρτηριακή πίεση, καθώς και το ενδεχόμενο κατάχρησης και εξάρτησης. Υπήρξαν επίσης αναφορές σεξουαλικής κακοποίησης κατά τη διάρκεια των κλινικών δοκιμών, γεγονός που περιπλέκει περαιτέρω την αξιολόγηση του προφίλ ασφάλειας του MDMA.
Απάντηση της Lykos Therapeutics
Σε απάντηση στην απόφαση της συμβουλευτικής επιτροπής, η διευθύνουσα σύμβουλος της Lykos Therapeutics Amy Emerson εξέφρασε απογοήτευση αλλά όχι έκπληξη για το αποτέλεσμα. Η Emerson υπογράμμισε τη συνεχιζόμενη συνεργασία με τον FDA για την αντιμετώπιση των προβληματισμών που τέθηκαν, εστιάζοντας ιδιαίτερα στην εθνική κρίση της μετατραυματικής διαταραχής που επηρεάζει περίπου 13 εκατομμύρια Αμερικανούς. Η Lykos αναγνώρισε τα ζητήματα σχετικά με τη συλλογή δεδομένων, ιδίως την έλλειψη συστηματικής καταγραφής των θετικών υποκειμενικών επιδράσεων, όπως η ευφορία. Αυτό το κενό στη συλλογή δεδομένων θεωρήθηκε σημαντική παράλειψη. Ωστόσο, η Lykos έχει δεσμευτεί να διορθώσει αυτά τα ζητήματα και να βελτιώσει τα πρωτοκολλα της. Έχουν εφαρμόσει μέτρα για να διασφαλίσουν ότι όλες οι θετικές, ουδέτερες ή αρνητικές επιδράσεις αναφέρονται σε τρέχουσες και μελλοντικές δοκιμές.
Κριτική και ισχυρισμοί για πρακτικές που μοιάζουν με αίρεση
Η ακρόαση του FDA δεν ήταν απλώς ένα πεδίο μάχης για την ερμηνεία των δεδομένων, αλλά και μια πλατφόρμα για ευρύτερες επικρίσεις του MAPS/Lykos. Επικεφαλής αυτών των επικρίσεων είναι η Nese Devenot, ανώτερη λέκτορας στο Πανεπιστήμιο Johns Hopkins. Η Devenot, μαζί με την ερευνητική δημοσιογραφική κολεκτίβα Psymposia, έχει ασκήσει έντονη κριτική, ισχυριζόμενη ότι η MAPS λειτουργεί περισσότερο σαν θεραπευτική αίρεση παρά σαν επιστημονικός οργανισμός.
Η λεπτομερής ανάλυση της Devenot που υποβλήθηκε στον FDA υπογραμμίζει τον τρόπο με τον οποίο η MAPS φέρεται να εκμεταλλεύεται τις ιδιότητες του MDMA που ενισχύουν την υποβλητικότητα για να προωθήσει μια ευαγγελική αποστολή πνευματοποίησης της ανθρωπότητας. Το ερευνητικό ρεπορτάζ της έφερε στο φως πολυάριθμες μαρτυρίες συμμετεχόντων και πρώην εργαζομένων που απεικονίζουν μια ανησυχητική εικόνα της εσωτερικής κουλτούρας και των κλινικών πρακτικών του οργανισμού. Οι ανησυχίες της Devenot επεκτείνονται και στα συγκεκριμένα θεραπευτικά πρωτόκολλα που χρησιμοποιούνται στις δοκιμές, τα οποία, όπως υποστηρίζει, αυξάνουν τους κινδύνους για τους ασθενείς, ιδίως για εκείνους με μετατραυματική διαταραχή που σχετίζεται με σεξουαλική επίθεση και τραύματα μειονοτήτων. Υποστηρίζει ότι η μεθοδολογία της MAPS προωθεί μια ολοκληρωτική ιδεολογία που θέτει σε κίνδυνο την ασφάλεια και την αυτονομία των ασθενών. Σύμφωνα με την Devenot, ο εσωτερικός κύκλος της MAPS υποκρύπτει πεποιθήσεις και πρακτικές που αντικατοπτρίζουν εκείνες των ομάδων υψηλού ελέγχου, δίνοντας προτεραιότητα στην ιδεολογική συμμόρφωση έναντι της επιστημονικής αυστηρότητας και των δεοντολογικών προτύπων. Η Psymposia έχει επίσης κρούσει τον κώδωνα του κινδύνου για διάφορες πτυχές των δραστηριοτήτων της MAPS, συμπεριλαμβανομένων ισχυρισμών για παραπτώματα και παραβιάσεις δεοντολογίας. Οι αναφορές τους υποδηλώνουν ότι ορισμένοι συμμετέχοντες αισθάνθηκαν πιεσμένοι να αναφέρουν θετικά αποτελέσματα, φοβούμενοι ότι η αρνητική ανατροφοδότηση θα μπορούσε να εμποδίσει την πρόοδο της έγκρισης του MDMA. Αυτές οι επικρίσεις υπογραμμίζουν την ανάγκη για ενδελεχή και διαφανή εξέταση των πρακτικών της MAPS, ώστε να διασφαλιστεί η ασφάλεια και η ευημερία των συμμετεχόντων στη δοκιμή.
Ευρωπαϊκές προοπτικές του PAREA.EU και άλλων εμπειρογνωμόνων
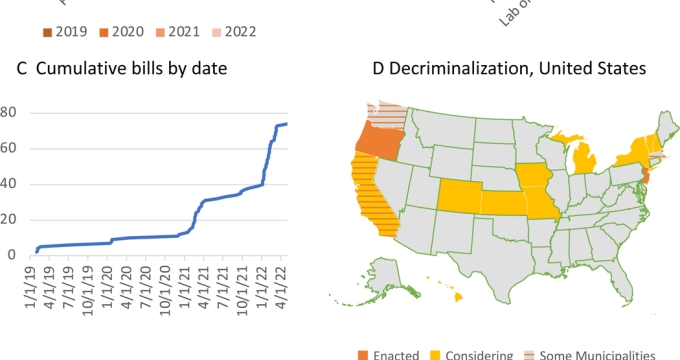
Η απόφαση του FDA είχε αντίκτυπο πέρα από τις Ηνωμένες Πολιτείες, εγείροντας ερωτήματα και ανησυχίες στην παγκόσμια ψυχεδελική κοινότητα. Ο Tadeusz Hawrot από την PAREA (Psychedelic Access and Research in Europe Alliance) υπογράμμισε τις ευρύτερες επιπτώσεις της απόφασης του FDA για την Ευρώπη. Ο Hawrot, μαζί με εμπειρογνώμονες όπως οι καθηγητές David Nutt και Jo Neill του Drug Science, εξέφρασαν την έκπληξή τους για την απόρριψη, δεδομένων των σημαντικών κλινικών στοιχείων που υποστηρίζουν την αποτελεσματικότητα του MDMA. Ο Hawrot επεσήμανε ότι η απόφαση έρχεται σε έντονη αντίθεση με άλλες εθνικές ομάδες εμπειρογνωμόνων που ενέκριναν τις θεραπευτικές δυνατότητες της MDMA. Στην Ελβετία, η MDMA χρησιμοποιείται σε συμπονετική βάση εδώ και χρόνια, και το 2023, η Υπηρεσία Θεραπευτικών Αγαθών (TGA) της Αυστραλίας ενέκρινε την MDMA για την ανθεκτική στη θεραπεία PTSD. Ομοίως, μια ολλανδική επιτροπή συνέστησε πρόσφατα τη θεραπευτική χρήση του MDMA, τονίζοντας την αποτελεσματικότητα και την ασφάλειά του.
Για την Ευρώπη, και ιδιαίτερα για την Ελλάδα, η απόφαση αυτή έχει σημαντική βαρύτητα. Η Ελλάδα ανοίγεται σταδιακά στις δυνατότητες των ψυχεδελικών θεραπειών, με αυξανόμενο ενδιαφέρον από την ιατρική κοινότητα και τους φορείς χάραξης πολιτικής. Η απόρριψη από τον FDA θα μπορούσε να επιβραδύνει τη δυναμική, αλλά αποτελεί επίσης μια ευκαιρία για τις ευρωπαϊκές χώρες να αναλάβουν ηγετικό ρόλο στην ψυχεδελική έρευνα και θεραπεία.
Ελπιδοφόρες προοπτικές για το μέλλον
Παρά τις οπισθοδρομήσεις και τις επικρίσεις, παραμένει μια ελπιδοφόρα προοπτική για την έγκριση της θεραπείας με MDMA. Η απόρριψη από τη συμβουλευτική επιτροπή αποτελεί σημαντικό εμπόδιο, αλλά δεν είναι το τέλος του δρόμου. Η τελική απόφαση του FDA, η οποία αναμένεται έως τις 11 Αυγούστου 2024, θα λάβει υπόψη της τα ολοκληρωμένα δεδομένα και τις απαντήσεις της Lykos Therapeutics. Η δυνατότητα του MDMA να φέρει επανάσταση στη θεραπεία της PTSD είναι αδιαμφισβήτητη, όπως αποδεικνύεται από τις σημαντικές βελτιώσεις που παρατηρούνται στις κλινικές δοκιμές. Η εστίαση μετατοπίζεται τώρα στην αντιμετώπιση των ανησυχιών της επιτροπής μέσω αυστηρής ανάλυσης δεδομένων και ενισχυμένων πρωτοκόλλων ασφαλείας. Η διασφάλιση της ενδελεχούς και διαφανούς αναφοράς όλων των επιπτώσεων, θετικών και αρνητικών, και η εφαρμογή ισχυρών μέτρων για την πρόληψη και την αντιμετώπιση των παραπτωμάτων θα είναι ζωτικής σημασίας.
Όπως επεσήμανε ο Matthew Baggott, διευθύνων σύμβουλος της Tactogen, κατά τη διάρκεια της ακρόασης, οι κίνδυνοι που σχετίζονται με το MDMA είναι καλά κατανοητοί και τα οφέλη για τους ασθενείς με PTSD είναι σημαντικά. Με τις κατάλληλες διασφαλίσεις και τη συνέχιση της έρευνας, η θεραπεία με MDMA θα μπορούσε να αποτελέσει μια πρωτοποριακή θεραπευτική επιλογή για εκατομμύρια ανθρώπους που πάσχουν από PTSD.
Σε αυτή την κρίσιμη στιγμή, είναι σημαντικό για την ψυχεδελική κοινότητα να ενωθεί, να διατηρήσει τα υψηλότερα πρότυπα επιστημονικής ακεραιότητας και να συνεχίσει να υποστηρίζει την ασφαλή και αποτελεσματική χρήση του MDMA στη θεραπεία. Το ταξίδι ήταν μακρύ και απαιτητικό, αλλά η πρόοδος που έχει σημειωθεί μέχρι στιγμής παρέχει ισχυρά θεμέλια για μελλοντική επιτυχία. Η ελπίδα παραμένει ότι με συνεχή αφοσίωση και συνεργασία, το MDMA θα λάβει τελικά την έγκριση που χρειάζεται για να βοηθήσει όσους έχουν απεγνωσμένη ανάγκη από αποτελεσματική θεραπεία της PTSD.